Jądro
Wyspa stabilności - poszukiwanie nowych jąder
 W naturze występują 94 pierwiastki chemiczne - od wodoru (który ma w jądrze
jeden proton) do plutonu (94 protony).
Pozostałe pierwiastki, które dzisiaj znamy, nie występuje nigdzie na Ziemi.
Naukowcy otrzymali je w laboratorium w sposób sztuczny.
Niestety okazało się, że kolejnych nowych pierwiastków nie da się już tak łatwo
wytwarzać - im większe jądro, tym jest mniej trwałe. Większość rozpada się
po przeżyciu zaledwie milisekund. Numer 112 nazwany copernicium naukowcy uzyskali w laboratorium na zaledwie 280 mikrosekund.
Każdy następny pierwiastek z tablicy Mendelejewa ma większe jądro, a w jego
wnętrzu więcej protonów i neutronów. Protony obdarzone są ładunkiem dodatnim.
Zgodnie z prawem Coulomba ładunki o tym samym znaku się odpychają.
Każde jądro atomowe powinno się więc rozpaść. Na szczęście tak się nie dzieje.
Natura wymyśliła bowiem, że unikające siebie z daleka protony, kiedy znajdą się
bardzo, bardzo blisko siebie - przyciągają się. Dodatkowym "lepiszczem" jądra są
jeszcze neutrony, cząstki pozbawione ładunku elektrycznego, które nie odpychają
się ani z protonami, ani ze sobą nawzajem, tylko sklejają jądro w całość.
Jak jednak wytłumaczyć fenomen; że jądra niektórych atomów
są trwalsze od pozostałych?
W naturze występują 94 pierwiastki chemiczne - od wodoru (który ma w jądrze
jeden proton) do plutonu (94 protony).
Pozostałe pierwiastki, które dzisiaj znamy, nie występuje nigdzie na Ziemi.
Naukowcy otrzymali je w laboratorium w sposób sztuczny.
Niestety okazało się, że kolejnych nowych pierwiastków nie da się już tak łatwo
wytwarzać - im większe jądro, tym jest mniej trwałe. Większość rozpada się
po przeżyciu zaledwie milisekund. Numer 112 nazwany copernicium naukowcy uzyskali w laboratorium na zaledwie 280 mikrosekund.
Każdy następny pierwiastek z tablicy Mendelejewa ma większe jądro, a w jego
wnętrzu więcej protonów i neutronów. Protony obdarzone są ładunkiem dodatnim.
Zgodnie z prawem Coulomba ładunki o tym samym znaku się odpychają.
Każde jądro atomowe powinno się więc rozpaść. Na szczęście tak się nie dzieje.
Natura wymyśliła bowiem, że unikające siebie z daleka protony, kiedy znajdą się
bardzo, bardzo blisko siebie - przyciągają się. Dodatkowym "lepiszczem" jądra są
jeszcze neutrony, cząstki pozbawione ładunku elektrycznego, które nie odpychają
się ani z protonami, ani ze sobą nawzajem, tylko sklejają jądro w całość.
Jak jednak wytłumaczyć fenomen; że jądra niektórych atomów
są trwalsze od pozostałych?Według współczesnej teorii jądro atomowe można wyobrażać sobie jak cebulkę. Nukleony (czyli protony i neutrony) zapełniają w jądrze kolejne warstwy - powłoki. Tak samo zresztą kolejne powłoki wypełniają elektrony. które obiegają jądro atomu. Na każdej powłoce może się zmieścić tylko określona liczba protonów oraz neutronów ani trochę więcej. Okazuje się, że najtrwalsze są jądra tych pierwiastków, których powłoki są zapełnione całkowicie. Fizycy mówią o nich, że mają magiczną liczbę nukleonów. Takimi magicznymi liczbami są: 2, 8, 20, 28, 50, 82, 126 oraz najprawdopodobniej 184.
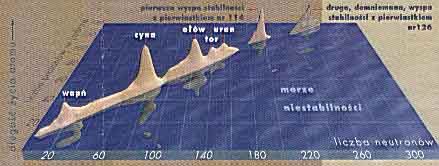
Magiczną liczbę protonów, mają: np.; hel (2 protony), tlen (8 protonów), wapń (28 protonów), cyna (50 protonów) i ołów (82 protonów). Ołów jest najcięższym ze znanych pierwiastków, który jest podwójnie magiczny, tzn. oprócz magicznej liczby protonów: (82) ma także magiczną liczbę neutronów (126). Następnym podwójnie magicznym pierwiastkiem jest pierwiastek 114, w którego jądrze znajduje się 114 protonów oraz 184 neutrony.. Teoretycy wyliczyli, że w ich okolicach będzie nawet coś, co nazwać można wyspą stabilności - pierwiastki zamiast rozpadać się w okamgnieniu, będą żyć latami. W lutym 1999 roku rosyjskim fizykom w Dubnej udało się otrzymać jądro zawierające 114 protonów i mające czas połowicznego rozpadu aż pół minuty. Otrzymany izotop miał jedynie 175 neutronów, a więc zabrakło mu dziewięciu neutronów, by osiągnął magiczną ich liczbę i być może zyskał jeszcze większą trwałość.
Kolejna wyspa stabilności powinna, tkwić wokół pierwiastka nr 126 Za pierwiastkiem 126 jest otchłań nieznanego oceanu. Teoretyczne modele tam zawodzą i nie dają żadnych sensownych podpowiedzi. Niektórzy spekulują, że kresem tablicy Mendelejewa jest pierwiastek nr 200. Większa liczba protonów w jądrze doprowadziłaby do wychwycenia elektronów na najbliższych orbitach, zapadnięcia się i katastrofy całego atomu. Z niej powstałoby jądro o mniejszej liczbie protonów.
Atomy egzotyczne
Atom wodoru składa się z jądra (w zwykłym wodorze jest to proton) i elektronu krążącego wokół jądra. Jeśli jądro zostanie zastąpione cząstką elementarną, naładowaną dodatnio to powstanie układ związany cząstki dodatniej i ujemnego elektronu. Przykładem takiej cząstki jest pozytonium (e+ e-) - układ pozytonu e+ i elektronu e-. Co prawda po spotkaniu się cząstki z antycząstką następuje anihilacja. Jednak często powstaje związany układ dostatecznie długo żyjący. Średni czas życia pozytonium zależy od wzajemnego usytuowania spinów elektronu i pozytonu. Gdy spiny pozytonu i elektronu są skierowane równolegle (ortopozytronium) spin wypadkowy wynosi jeden, a czas średni życia wynosi 1,4*10-7 sekundy. Gdy spiny pozytonu i elektronu są skierowane przeciwnie (parapozytonium) spin wypadkowy wynosi zero, a średni czas życia jest znacznie krótszy i wynosi 1,25*10-10 sekundy.
Podobnym przykładem jest układ antymionu z elektronem, zwany mionium (m+,e-).
Jeżeli natomiast w atomie zwyczajnym o liczbie atomowej Z jeden z elektronów powłokowych e- zostanie zastąpiony cząstką naładowaną ujemnie, np. mionem, pionem minus, kaonem minus, antyprotonem lub hiperonem sigma minus to powstanie odpowiednio atom mionowy, pionowy, kaonowy, antyprotonowy lub hiperonowy. Składa się on z jądra o liczbie atomowej Z, cząstki ujemnej (o masie o wiele większej niż elektron) związanej w polu kulombowskim jądra oraz Z-1 elektronów powłokowych. Takie atomy nazywamy atomami egzotycznymi. Stosuje się też często nazwę mezoatomy lub atomy mezonowe (nie tylko w tych wypadkach, gdy cząstką związaną jest mezon, lecz i wtedy, gdy jest nią mion lub barion). Wszystkie wymienione atomy egzotyczne zostały zaobserwowane w doświadczeniach.
Interesujące rezultaty otrzymano badając oddziaływania mionów z izotopami wodoru. Mion ma masę 207 razy większą niż elektron, pozostałe zaś własności są takie same jak elektronu. Dzięki temu mion łatwo może zamienić elektron na jego orbicie w atomie, ale promień orbity mionu będzie około 200 razy mniejszy od promienia orbity elektronu. Takie atomy mogą się zbliżyć na dużo mniejsze odległości. Może to mieć znaleźć w energetyce jądrowej. Jest nadzieja, że takie cząstki będą mogły uczestniczyć w zimnej fuzji, czyli reakcji syntezy jądrowej (fuzji jądrowej) w temperaturach pokojowych.
Przy opracowaniu tematu najwięcej korzystano z następujących publikacji:
Encyklopedia fizyki współczesnej;
Czesław Bobrowski, Fizyka - krótki kurs;
| « Poprzednia |